细菌趋化系统响应不同氧气浓度的调控机制研究获得新进展
本报讯 中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室研究员高贝乐团队在空肠弯曲菌中发现了一个新型趋化蛋白CheO,该蛋白在微氧环境下能调节鞭毛马达的旋转,对空肠弯曲菌在小鼠肠道中的定殖过程有重要作用。相关研究成果以“Polar localization of CheO under hypoxia promotes Campylobacter jejuni chemotactic behavior within host”为题,在线发表于PLOS Pathogens(《公共科学图书馆:病原体》)。
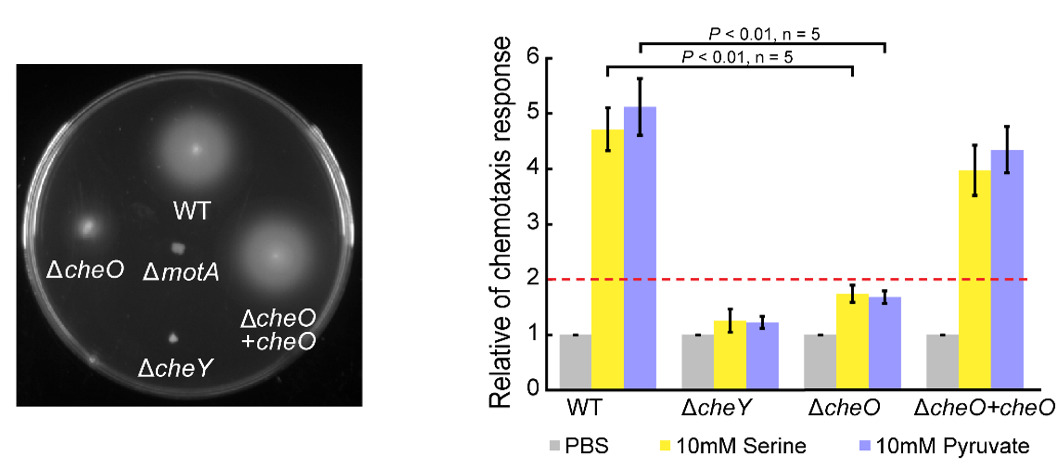
图1.CheO调节了C. jejuni的趋化行为
空肠弯曲菌(Campylobacter jejuni)是世界范围内引起食源性细菌性胃肠炎的最常见诱因,该病原菌在微氧环境下(氧气含量5%-10%)才能生长以适应肠道中的氧气限制,同时它也可以在氧浓度较高的环境中存活,以抵抗宿主的氧化攻击。与其它肠道病原菌相比,空肠弯曲菌具有严格的生长和营养需求,但缺乏许多因致病或与宿主相互作用而进化的毒力因子。空肠弯曲菌的趋化作用在宿主体内的定殖过程中发挥了重要作用,然而目前尚不清楚空肠弯曲菌的趋化系统如何感知和响应环境氧气变化。此外,空肠弯曲菌中也没有化学感受蛋白或其他感受蛋白被鉴定为氧浓度感受蛋白,其它趋化调控蛋白在氧浓度波动的环境下是否发挥不同的作用也尚未清楚。
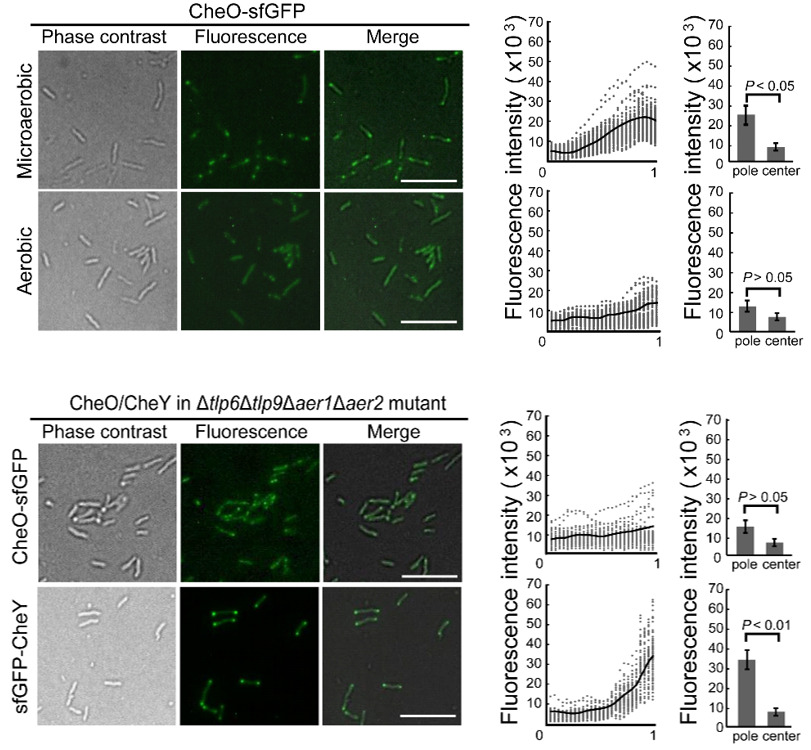
图2.环境氧浓度和C. jejuni的能量趋化相关化学感受蛋白影响CheO的极点定位
本研究团队前期通过筛选空肠弯曲菌C. jejuni 81-176突变子文库,发现了一个在弯曲菌门中特有的蛋白CJJ81176_1265。在C. jejuni 81-176中敲除CJJ81176_1265基因后,敲除株在小鼠体内的定殖能力显著弱于野生型,表明该基因的功能与空肠弯曲菌在小鼠肠道内的定殖有关。后续的突变株表型检测中发现该敲除株的趋化能力也显著弱于野生型, 随后对敲除株进行单细胞轨迹追踪,发现该基因的缺失影响了菌体游动过程中的翻转频率(图1)。荧光显微镜观察表明CheO的定位依赖于趋化蛋白阵列,但独立于反应调节蛋白CheY。蛋白相互作用实验证实CheO与趋化系统磷酸激酶CheA、磷酸酶CheZ和鞭毛马达蛋白FliM、FliY有相互作用。有趣的是,在微氧条件下,CheO定位在细胞极;而在正常氧浓度环境下,CheO蛋白在细菌体内呈现通体分布。而且,CheO的定位依赖于4个能量趋化相关的化学感受蛋白(Aer1, Aer2, Tlp6, Tlp9),因此CJJ81176_1265蛋白被命名为CheO(Chemotaxis protein responding to Oxygen)(图2)。缺少CheO的菌株在低氧环境下运动能力减弱,研究人员对ΔcheO突变株进行抑制子筛选,发现鞭毛马达蛋白FliM的点突变FliML99F能恢复其运动能力,即FliM的单个残基变异可以替代CheO蛋白缺失而导致的表型。这些结果表明CheO建立了一条从趋化蛋白阵列到鞭毛马达的信号旁路,这种条件型激活机制体现了细菌对不同氧浓度的适应性。此外,CheO同源蛋白只存在于弯曲菌门的部分物种中,其同源蛋白在空肠弯曲菌中的表型实验证实了CheO的同源蛋白均具有趋化调节功能。
综上所述,CheO是C. jejuni响应环境氧浓度变化的趋化调控蛋白,促进了微氧环境下的菌体的趋化能力。该研究揭示了空肠弯曲菌对人和动物肠道适应的新策略,深入研究这个非核心趋化信号转导蛋白的作用机制可揭示C. jejuni不同于其它细菌的趋化信号传递模式。
中国科学院南海海洋研究所2022届博士莫然为该论文的第一作者,高贝乐研究员为通讯作者。本研究得到了国家自然科学基金、南方海洋科学与工程引进人才团队重点专项广东实验室(广州)、中国科学院战略性先导专项、中国科学院南海生态与环境工程创新研究院的资助。
相关论文信息:https://doi.org/10.1371/journal.ppat.1010953
通讯员|刘娟 徐晓璐