本报讯 近日,中国科学院南海海洋研究所张长生团队在海洋微生物天然产物everninomicin的生物合成及工程菌株构建研究中取得新进展,相关成果以“Biosynthesis and Engineered Overproduction of Everninomicins with Promising Activity against Multidrug-Resistant Bacteria”为题,于2022年4月21日在线发表于ACS Synthetic Biology(《ACS合成生物学》)。
靶向细菌核糖体的正糖霉素类天然产物具有特殊的高度修饰的寡糖骨架,与目前商用的核糖体靶向抗生素如大环内酯类、四环素类和氨基糖苷类等抗生素靶点均不同,不易产生交叉耐药,具有进一步开发的潜力。具有八糖骨架的everninomicin D是小单胞菌产生的正糖霉素类天然产物,自上世纪60年代起由美国先灵葆雅公司(Schering-Plough)分离鉴定,该公司通过调研发现其具有良好的抑菌活性。然而everninomicin的生物合成及代谢工程研究一直受限于野生型菌株的产量低下,其生物合成研究及构效关系分析一直进展缓慢。

图1.利用基因簇倍增的方法获得增加多种everninomicin类天然产物及其与商用抗生素的活性比较
研究团队以生物活性为导向,发现南海来源的小单胞菌SCSIO 07395(田新朋研究员提供)具有产生微量everninomicin 类化合物的能力。由于该类化合物生物合成步骤较多,结构复杂且代谢关键节点未知,暂时难以开展理性的代谢工程研究,于是采取了直接增加整个生物合成基因簇的拷贝数的方法进行增产(图1)。通过活性检测及代谢物分析发现,与野生型菌株相比,工程菌株的everninomicin 类化合物1-4的产量显著提升,同时还产生了野生型不产的新类似物5和6(图1)。
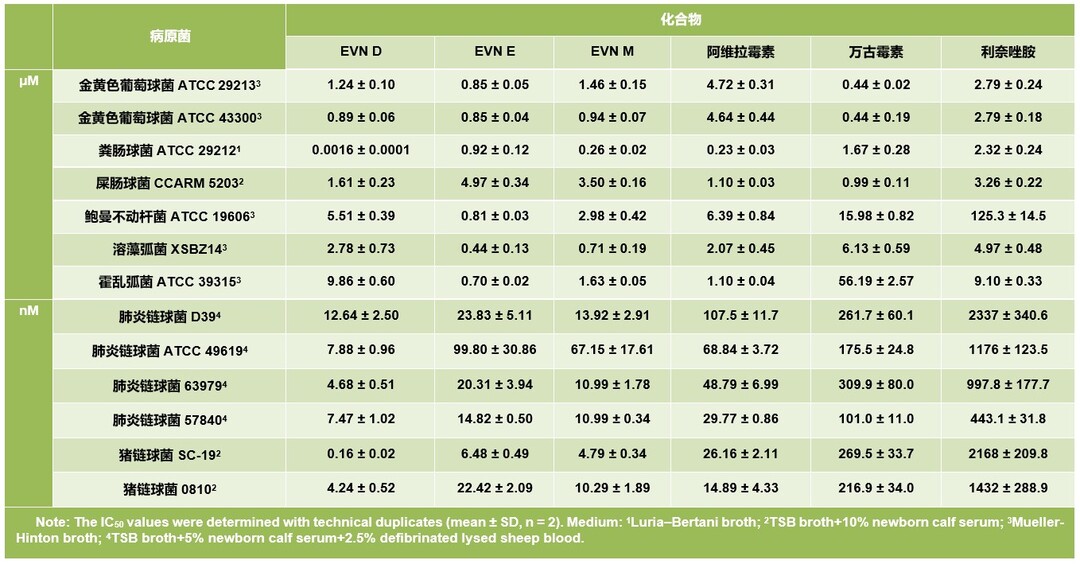
表1.everninomicins与阿维拉霉素、万古霉素及利奈唑胺对多种病原菌的半抑制浓度比较
将工程菌株发酵分离得到的everninomicin类似物与包括5种氨基糖苷类、3种大环内酯类、3种β-内酰胺类和3种四环素类在内的28种商用抗生素在体外对21株革兰氏阳性菌及7种革兰氏阴性菌进行了系统的活性比较。结果显示everninomicin对葡萄球菌、肠球菌和链球菌活性显著,整体活性优于除thiostrepton和rifamycin外其他抗生素;此外,everninomicins对阴性菌中的鲍曼不动杆菌、霍乱弧菌和溶藻弧菌也具有中等强度的活性(图1)。
然后进一步选择了抑菌谱相似的vancomycin、linezolid及avilamycin同化学性质稳定的everninomicin D、E和M进行了半抑制浓度(IC50)的比较。测试结果显示everninomicin D、E和M对葡萄球菌和肠球菌的IC50与vancomycin、linezolid及avilamycin相当;对于链球菌则显示出明显的优势,特别是everninomicin D和M在体外对肺炎链球菌及猪链球菌显示出纳摩尔级水平的抑制作用;此外,everninomicin E对三种革兰氏阴性病原体鲍曼菌、溶藻弧菌和霍乱弧菌活性较为显著(表1)。最后,进一步利用基因簇倍增技术构建了everninomicin M的高产菌株,目前最高产量可达98.6 mg/L,为后续动物实验提供了物质基础。
综上所述,本研究从南海来源的野生型小单胞菌出发,针对结构及合成途径均非常复杂的天然产物,克服了野生型菌株遗传操作上的困难,直接通过增加生物合成基因簇的拷贝数达成了初步的产量提升及化学多样化,成功制备出多种具有显著活性的everninomicin类似物,为快速提高微量且复杂的活性天然产物的产量供生物合成及构效关系研究提供了参考案例。
博士后朱梦奕和王利娟为本文共同第一作者,张长生研究员为本文通讯作者。本研究得到了国家重点研发计划项目、国家自然科学基金委项目、博士后创新人才支持计划、中国博士后科学基金、广东省基础与应用基础研究基金、广东省海洋经济发展专项资金项目、王宽诚教育基金项目、海南省重大科技计划项目、广东省培养高层次人才特殊支持计划和广东省重点领域研发计划项目等资助。
相关论文信息:Mengyi Zhu#, Lijuan Wang#, Haibo Zhang, Liping Zhang, Bin Tan, Qi Huang, Yiguang Zhu, and Changsheng Zhang*. Biosynthesis and Engineered Overproduction of Everninomicins with Promising Activity against Multidrug-Resistant Bacteria. ACS Synthetic Biology 2023, DOI: 10.1021/acssynbio.3c00055.
https://pubs.acs.org/doi/10.1021/acssynbio.3c00055
通讯员|朱梦奕 徐晓璐